Ictus y Epilepsia
INTRODUCCIÓN
El ictus y las crisis epilépticas constituyen uno de los problemas neurológicos más prevalentes en el mundo occidental. La enfermedad cerebrovascular es la causa más común de epilepsia en adultos, representando alrededor de un tercio de las epilepsias sintomáticas con inicio en mayores de 60 años (Lossius MI et al; 2005). La coexistencia de ambas patologías empeora el pronóstico médico y social, y multiplica la incapacidad que se asocia a cada patología por separado.
EPIDEMIOLOGÍA
El ictus es la causa más frecuente de epilepsia sintomática en adultos, siendo responsable de hasta el 11% de todas las etiologías (Hauser WA et al; 1993, Forsgren et al; 1996). En personas mayores de 60 años constituye la primera causa de epilepsia (Lossius MI et al; 2005); un tercio de las crisis epilépticas en personas de esta edad es secundario a esta patología. El ictus se asocia a un aumento de 23-35 veces la incidencia de crisis. El riesgo de desarrollar epilepsia tras un ictus es 17 veces mayor que en personas de la misma edad sin esta patología (So et al; 1996).
Las crisis postictus se clasifican según el criterio temporal en precoces o tardías. Este criterio no está del todo establecido y podemos ver que varía según los estudios; la Liga Internacional contra la Epilepsia define como crisis precoces las ocurridas dentro de los primeros 7-14 días después del ictus (Commission on Epidemiology and Prognosis, International League Against Epilepsy; 1993). En otros trabajos se consideran crisis precoces las que ocurren en las primeras 24 horas, 48 horas, una semana, dos semanas o un mes después del ictus. No obstante, para la mayoría de los autores las crisis tardías son las que ocurren después de las dos primeras semanas. De acuerdo a estudios prospectivos la frecuencia de las crisis precoces oscila entre un 4% a un 6.5% (crisis ocurridas en las dos primeras semanas del ictus) (Kilpatrick et al; 1990, Giroud et al; 1994, Bladin et al; 2000). Muchos estudios establecen una frecuencia de crisis tardías y epilepsia en torno al 2-10% de los pacientes que tuvieron un ictus (Lamy C et al; 2003, Naess H et al; 2004). El riesgo de padecer epilepsia es acumulativo a lo largo de los años y es mayor en los pacientes que tuvieron crisis tardías (entre el 54 al 66% de los pacientes de acuerdo a algunas series) (So et al; 1996, Bladin Cf et al; 2000, Lamy C et al; 2003, Lossius MI et al; 2005). En un estudio prospectivo en pacientes con ictus menores de 55 años, aquellos con crisis precoces tuvieron un riesgo 5 veces mayor de tener crisis tardías y hubo una tasa de recurrencia del 55% en aquellos que experimentaron una primera crisis tardía (Lamy C et al; 2003).
FISIOPATOLOGÍA
Los mecanismos fisiopatológicos alterados en las crisis precoces y tardías son diferentes. Las primeras se producen por una alteración bioquímica a nivel celular (Luhmann HJ; 1996) y por cambios homeostáticos locales y sistémicos (p. ejemplo alteración del equilibrio ácido-base o iónico). La hiperglucemia en el momento de la isquemia también favorece este tipo de crisis.
Las crisis tardías pueden aparecer incluso meses o años después del insulto isquémico inicial lo que conlleva una serie de cambios progresivos a nivel neuronal que favorecen el desarrollo de epilepsia. Las causas potenciales de epileptogénesis en el ictus no son del todo claras. Se han propuesto diferentes mecanismos como la pérdida neuronal y apoptosis con sustitución por tejido gliótico, cambios mitocondriales y en las propiedades de la membrana celular, alteración de los receptores de neurotransmisores, desaferentización y la aparición de conexiones neuronales aberrantes (Stroemer RP et al., 1995). Se piensa que el tejido en penumbra puede favorecer el desarrollo posterior de epilepsia; se ha demostrado que la isquemia aguda aumenta la liberación de glutamato, neurotransmisor excitatorio, y de forma paralela favorece la disfunción de las interneuronas GABAérgicas (inhibitorias). Este desequilibrio entre excitación e inhibición favorecería un estado continuo de hiperexcitabilidad neuronal perilesional.
FACTORES DE RIESGO
Son varios los factores que se han relacionado con el riesgo de presentar crisis epilépticas precoces y epilepsia:
Subtipo de ictus:
Las hemorragias cerebrales parenquimatosas (especialmente las lobares), la trombosis venosa cerebral y la hemorragia subaracnoidea se asocian a un mayor riesgo de crisis precoces en comparación con el ictus isquémico. No obstante no está claro si este riesgo es también mayor a la hora de desarrollar epilepsia a largo plazo. Los resultados de varios estudios difieren en este sentido; en la serie prospectiva más larga, el riesgo de crisis tardías fue de 2.6% para ictus hemorrágicos vs 3.8% para ictus isquémicos (Bladin CF et al; 2000). Otras series más recientes ofrecen resultados diferentes, con un riesgo de epilepsia del 13% para ictus hemorrágicos y del 2.7% para ictus isquémicos (Benbir G et al; 2006). El riesgo de epilepsia en pacientes con hemorragia subaracnoidea y de trombosis cerebral venosa es del 7% y 5-26% respectivamente (Claassen J et al: 2003, Ferro et al; 2003, Benbir et al; 2006). Los estudios prospectivos más importantes no han mostrado que el ictus cardioembólico se asocie a un mayor riesgo desarrollar epilepsia (Kittner SJ et al; 1990, Bladin et al; 2000).
Localización:
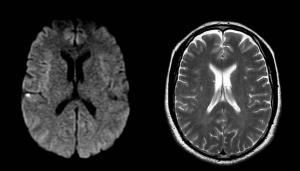
La afectación cortical es uno de los factores más importantes que determinan tanto el desarrollo de crisis epilépticas en la fase aguda del ictus como epilepsia a largo plazo. Algunos estudios han identificado esta variable como factor de riesgo independiente del tamaño o extensión de la afectación cortical (Bladin et al; 2000) (Ver Figura 1 JPG). Es controvertido si el riesgo de epilepsia está determinado por la localización del ictus; algunos autores indican que es más frecuente presentar epilepsia en pacientes con ictus que afectan al lóbulo temporal (So EL et al; 1996), occipital o temporo-parietal. Aunque se describe epilepsia en pacientes con ictus lacunares o de tronco encefálico no es posible excluir que además exista afectación cortical no identificada en la exploración o la neuroimagen. La persistencia de tejido neuronal viable en el seno del tejido infartado (p. ejemplo, “islotes de tejido sano” en el estudio de neuroimagen) se ha relacionado con un mayor riesgo de epilepsia (Pohlmann-Eden B et al; 2001). Se postula que este tejido viable podría establecer conexiones aberrantes y así generar circuitos neuronales anómalos.
Figura 1. Paciente con crisis epilépticas precoces postictus. La RM cerebral 24 horas después del ictus muestra un infarto cortical de muy pequeño tamaño en las secuencias DWI. En la secuencia T2 se observan tan sólo infartos subcorticales antiguos.
Extensión:
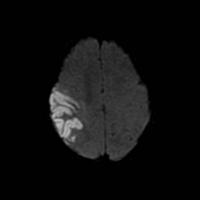
Es controvertido si la extensión del ictus es un factor pronóstico per se o es una variable dependiente de otros factores (Ver Figura 2 jpg). De este modo, algunos estudios donde se ha analizado esta variable teniendo en cuenta la localización y el subtipo de ictus no mostraron que la extensión fuera un factor pronóstico independiente (Camilo et al; 2004). La transformación hemorrágica aumenta el riesgo de epilepsia de forma independiente a otras variables (Bladin et al; 2000), probablemente en relación con la irritabilidad que genera la sangre y los productos de su degradación.
Figura 2. RM cerebral (DWI) que muestra un infarto cortical extenso en un paciente con crisis epilépticas precoces.
TIPOS DE CRISIS
La semiología de las crisis en pacientes con epilepsia postictus está en relación con la localización del ictus. Aunque no todos los estudios muestran los mismos resultados, las crisis más frecuentes son las crisis parciales simples con o sin generalización secundaria (Giraud et al; 1994). En comparación con otras epilepsias, especialmente cuando las crisis se generan en el lóbulo central, es más frecuente encontrar parálisis postictal (parálisis de Todd). Este diagnóstico se ha de tener en cuenta para diferenciarlo de una nueva recurrencia. Es infrecuente desarrollar status epilepticus (SE) en la epilepsia postictus (<1%) (Lavovitz DL et al; 2001). No obstante en algunas series de SE donde se analizaron las distintas causas, el ictus fue responsable de alrededor del 25% de todas las etiologías (Afsar N et al; 2003).
VALOR DE LA ELECTROENCEFALOGRAFÍA
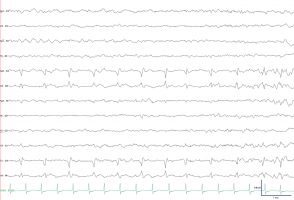
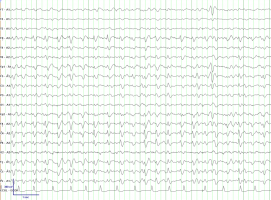
La monitorización EEG continua es útil en pacientes con ictus severos con bajo nivel de conciencia y permite identificar aquellos pacientes con crisis sutiles o con status no convulsivo, condiciones que pueden explicar el deterioro de un paciente que previamente se encontraba estable. Son múltiples los estudios que muestran que los pacientes críticos con ictus isquémicos, hemorragias lobares y hemorragias subaracnoideas presentan con frecuencia crisis subclínicas (crisis con manifestaciones clínicas sutiles) o eléctricas (crisis sin correlato clínico) (Ver Figura 3 jpg). En este sentido, algunos estudios indican un peor pronóstico en pacientes con estos hallazgos por lo que se recomienda tratarlos con fármacos antiepilépticos (Claassen et al; 2007). Los PLEDS (“periodic lateralizing epileptiform discharges”) son descargas epileptiformes periódicas, frecuentes en la fase aguda del ictus (Ver Figura 4 jpg). Es controvertido si esta anomalía electroencefalográfica es una consecuencia de la isquemia cerebral o representa verdadera actividad epileptiforme (SE). Este patrón EEG es más frecuente en pacientes con infartos corticales. De igual forma también es controvertido si deben ser tratados; como norma general se debe tratar a todo paciente con ictus que sufre deterioro neurológico (p. ejemplo empeoramiento motor o disminución del nivel de conciencia) con un EEG simultáneo que muestra PLEDS. También existe consenso en tratar a pacientes que presentan manifestaciones motoras evidentes y este patrón EEG (p. ejemplo clonias en una pierna).
Figura 3. Crisis electrográfica en un neonato con un ictus agudo en región central derecha.
Figura 4. PLEDS con afectación principal sobre región frontocentral derecha en un paciente con crisis motoras en pierna izquierda.
El valor pronóstico del EEG ambulatorio en pacientes con ictus es discutido. Algunos estudios han mostrado que los pacientes con anomalías epileptiformes y lentificación focal en el EEG presentan un mayor riesgo de desarrollar epilepsia (De Reuck J et al; 2006). No obstante estos datos no son compartidos por otros estudios donde los hallazgos anormales en el EEG no se asociaron a una mayor tasa de recurrencia (Temprano T et al; 2009).
PRONÓSTICO
El pronóstico funcional tras un ictus depende fundamentalmente de la localización y de la extensión del mismo. En la actualidad es discutido si las crisis repetidas pueden influir en la incapacidad o mortalidad asociada a esta patología. Estudios animales han mostrado que las crisis repetidas aumentan la extensión del tejido infartado y disminuyen la posibilidad de recuperación funcional. Las crisis aumentan el consumo de glucosa en el tejido isquémico, aumentando la liberación de metabolitos citotóxicos como lactato y glutamato, exacerbando el desequilibrio que ya existe en el tejido infartado entre la necesidad y de la demanda energética. Aunque no existe una clara evidencia en humanos, es lógico pensar que las crisis repetidas en la fase aguda del ictus puedan ser perjudiciales al añadir mayor estrés metabólico en un tejido que ya es vulnerable. En este sentido algunos estudios clínicos han encontrado una mayor mortalidad en pacientes con ictus que tuvieron crisis precoces, tanto en las primeras 48 horas, 30 días o incluso hasta el año después del ictus (Szaflarski JP et al; 2008). No obstante estos resultados podrían estar en relación con el hecho de que muchos de estos pacientes tuvieron un ictus más extenso, hallazgo que se asocia con un mayor riesgo de presentar crisis epilépticas. Otros estudios poblacionales no han obtenido estos resultados cuando han analizado sus series teniendo en cuenta la severidad del ictus (Labovitz DL et al; 2001). En la hemorragia cerebral, las crisis en la fase aguda se han correlacionado con un deterioro funcional y un mayor desplazamiento de la línea media (Vespa et al; 2003).
Varios estudios sugieren que las crisis tardías repetidas tienen un efecto nocivo sobre la capacidad de recuperación funcional a largo plazo. No obstante y al igual que ocurría con las crisis precoces no se pueden sacar conclusiones definitivas debido a limitaciones metodológicas. Uno de los estudios prospectivos más importantes señaló que los pacientes con crisis tenían un peor grado funcional a los 9 meses, no obstante, en este estudio no se especificó el valor de las crisis precoces vs tardías ni se consideró la extensión del ictus a la hora de determinar el valor de las crisis repetidas en el pronóstico funcional (Bladin et al; 2000). Un estudio posterior mostró que tanto los pacientes con una única crisis como con crisis repetidas tenían un déficit neurológico más severo y un infarto más extenso en la neuroimagen al mes del ictus. Estos autores también observaron que los pacientes con epilepsia tenían un mayor riesgo de desarrollar deterioro cognitivo (De Reuck J et al; 2006). En la misma línea, en los pacientes con hemorragia subaranoidea, la epilepsia es un factor de mal pronóstico y contribuye a una menor recuperación funcional (Claassen J et al; 2003). Algunos estudios indican que los pacientes con ictus y SE en la fase aguda pueden tener una mayor tasa de mortalidad. No obstante, de nuevo es difícil extraer conclusiones sobre este efecto ya que la mayoría de los estudios no consiguen evaluar esta relación de forma independiente a otras variables como la extensión o la localización del ictus. Se desconoce si el status no convulsivo afecta el pronóstico final en pacientes con ictus.
TRATAMIENTO
En la actualidad no existe evidencia científica que avale el uso de FAE de forma profiláctica o preventiva en pacientes que han presentado un ictus. El riesgo de una segunda crisis después de una primera crisis precoz es inferior al 43% (Lossius et al; 2005). Como se ha comentado antes, aunque la evidencia no es definitiva, las crisis en la fase aguda del ictus podrían influir negativamente en la funcionalidad a medio-largo plazo y en el riesgo de mortalidad. Por ello en la práctica clínica habitual existe consenso en tratar las crisis sintomáticas (precoces) de forma temporal y retirar el FAE una vez pasadas varias semanas o meses. No obstante hay que puntualizar que esta tendencia, al igual que el tratamiento de otras crisis sintomáticas, no ha demostrado que disminuya el riesgo de desarrollar epilepsia a largo plazo. La Asociación Americana del Ictus en unas guías recientemente publicadas sobre el manejo de la hemorragia subaracnoidea recomienda (nivel de evidencia B) el uso profiláctico de FAE en el periodo post-hemorrágico precoz con el fin de evitar los posibles efectos perjudiciales de las crisis (Bederson JB et al; 2009). De igual forma no recomienda el uso crónico de FAE en aquellos pacientes sin crisis (nivel de evidencia B) si bien puntualiza que se puede considerar en pacientes con un mayor riesgo (p. ejemplo hematoma parenquimatosos, aneurismas de ACM o infarto). Años antes, en otras guías publicadas sobre el tratamiento de la hemorragia cerebral espontánea se recomendaba el uso de FAE para el tratamiento sintomático de las crisis en la hemorragia cerebral espontánea (nivel de evidencia B), y con un menor grado de evidencia (nivel de evidencia C) se apunta que el tratamiento precoz con FAE en las hemorragias lobares puede disminuir el riesgo de crisis precoces (Broderick J et al; 2007).
El riesgo de una segunda crisis después de una primera crisis tardía varía entre un 54% y un 66% (So et al; 1996, Bladin Cf et al; 2000, Lamy C et al; 2003, Lossius MI et al; 2005). La decisión de no tratar una primera crisis no modifica el control a largo plazo. Por ello la decisión de iniciar un FAE ante una primera crisis tardía debe ser individualizado, basado principalmente en el impacto funcional que tuvo la primera crisis y las preferencias del paciente. La recurrencia de crisis tardías en pacientes con un ictus justifica el inicio de tratamiento crónico. A diferencia de otras epilepsias sintomáticas o criptogénicas, la epilepsia en el ictus suele responder al tratamiento farmacológico y no suele ser necesario emplear dosis elevadas de FAE. En la actualidad no existe ningún ensayo clínico en el que se hayan comparado explícitamente la eficacia de los distintos FAE en pacientes con ictus, por ello la elección del tratamiento antiepiléptico debe estar guiada por las características clínicas individuales de cada paciente. Los FAE inductores enzimáticos (carbamacepina, fenitoina y barbitúricos) pueden interaccionar con los anticoagulantes orales y disminuir significativamente su eficacia por lo que deben de ser evitados en pacientes que requieran anticoagulación crónica. La interacción con la aspirina no suele ser clínicamente significativa. Dado que muchos de los pacientes con ictus son mayores de 60 años es preferible emplear FAE que sean bien tolerados; gabapentina y lamotrigina han demostrado ser eficaces y bien tolerados en personas mayores en base a estudios con evidencia tipo A (Glauser T et al; 2006). En general la mayoría de los FAE nuevos (“segunda generación”) son apropiados en este grupo de pacientes, empleándose generalmente en monoterapia y a dosis bajas en comparación con otras epilepsias.
BIBLIOGRAFÍA
- Afsar N, Kaya D, Aktan S, Canan AB. (2003). Stroke and status epilepticus: stroke type, type of status epilepticus, and prognosis. Seizure. 12:23–27.
- Benbir G, Ince B, Bozluolcay M. (2006).The epidemiology of post-stroke epilepsy according to stroke subtypes. Acta Neurol Scand. 114:8–12.
- Bederson JB, Connolly ES Jr, Batjer HH, Dacey RG, Dion JE, Diringer MN et al.(2009). Guidelines for the management of aneurysmal subarachnoid hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 40:994-1025.
- Bladin CF, Alexandrov AV, Bellavance A, Bornstein N, Chambers B, Coté R, et al. (2000). Seizures after stroke: a prospective multicenter study. Arch Neurol. 57:1617–1622.
- Broderick J, Connolly S, Feldmann E, Hanley D, Kase C, Krieger D et al.(2007). Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Circulation.116: 391-413
- Camillo C, Goldstein LB. (2004). Seizures and epilepsy after ischemic stroke. Stroke. 35:1769-1775.
- Claassen J, Peery S, Kreiter KT, Hirsch LJ, Du EY, Connolly ES et al. (2003).Predictors and clinical impact of epilepsy after subrachnoid hemorrhage. Neurology. 60:208-214.
- Claassen J, Jetté N, Chum F, Green R, Schmidt M, Choi H et al. (2007). Electrographic seizures and periodic discharges after intracerebral hemorrhage. Neurology. 69:1356-1365.
- Commission on Epidemiology and Prognosis, International League Against Epilepsy. (1993). Guidelines for epidemiologic studies on epilepsy. Epilepsia. 34: 592-6.
- De Reuck J, Claeys I, Martens S, Vanwalleghem P, Van Maele G, Phlypo R et al. (2006). Computed tomographic changes of the brain and clinical outcome of patients with seizures and epilepsy after an ischaemic hemispheric stroke. Eur J Neurol. 13:402-407.
- De Reuck J, Goethals M, Claeys I, Van Maele G, De Clerck M. (2006). EEG findings after cerebral territorial infarct in patients who develop early-and late-onset seizures. Eur Neurol. 55 :209-13
- Ferro JM, Correia M, Rosas MJ, Pinto AN, Neves G; Cerebral Venous Thrombosis Portuguese Collaborative Study Group (VENO-PORT). (2003).Seizures in cerebral vein and dural sinus thrombosis. Cerebrovasc Dis. 15; 78–83.
- Forsgren L, Bucht G, Eriksson S, Bergmark L. (1996). Incidence and clinical characterization of unprovoked seizures in adults: a prospective population based study. Epilepsia. 37:224–229.
- Giroud M, Gras P, Fayolle H, Andre N, Soichot P, Dumas R. (1994). Early seizures after acute stroke: a study of 1640 cases. Epilepsia. 35:959-964.
- Glauser T, Ben-Menachem E, Bourgeois B, Cnaan A, Chadwick D, Guerreiro C, et al. (2006). ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia. 47:1094-1120.
- Hauser WA, Annegers JF, Kurland LT. (1993). Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota; 1935–1984. Epilepsia. 34:453-468.
- Kilpatrick CJ, Davis SM, Tress BM, Rossiter SC, Hopper JL, Vandendriesen ML. (1990).Epileptic seizures in acute stroke. Arch Neurol. 47:157-160.
- Kittner SJ, Sharkness CM, Price TR, Plotnick GD, Dambrosia JM, Wolf PA et al. (1990). Infarcts with a cardiac source of embolism in the NINCDS Stroke Data Bank: historical features. Neurology. 40:281–284.
- Labovitz DL, Hauser WA, Sacco RL. (2001). Prevalence and predictors of early seizure and status epilepticus after first stroke. Neurology. 57:200-206.
- Lamy C, Domigo V, Semah F, Arquizan C, Trystram D, Coste J et al.(2003). Early and late seizures after cryptogenic ischemic stroke in young adults. Neurology. 60: 400-404.
- Lossius MI, Ronning OM, Slapo GD, Mowinckel P, Gjerstad L. (2005). Poststroke epilepsy: occurrence and predictors: a long-term prospective controlled study (Akershus Stroke Study). Epilepsia. 46: 1246-51.
- Luhmann HJ. (1996). Ischemia and lesion induced imbalances in cortical function. Prog Neurobiol. 48:131-166.
- Naess H, Nyland, HI, Thomassen L, Aarseth J, Myhr KM. (2004). Long-term outcome of cerebral infarction in young adults. Acta Neurol. Scand. 110: 107-112.
- Pohlmann-Eden B, Fatar M, Hennerici M. (2001). The preserved cortical island sigh is highly predictive of postischemic seizures. Cerebrovasc Dis. 12:282.
- So EL, Annegers JF, Hauser WA, O'Brien PC, Whisnant JP. (1996). Population-based study of seizure disorders after cerebral infarction. Neurology. 46:350-355.
- Stroemer RP, Kent TA, Hulsebosch CE. (1995) Neocortical neural sprouting, synaptogenesis, and behavioral recovery after neocortical infarction. Stroke. 26, 2135-2144.
- Szaflarski JP, Rackley AY, Kleindorfer DO, Khoury J, Woo D, Miller R et al. (2008). Incidence of seizures in the acute phase of stroke: a population-based study. Epilepsia.49:974-81.
- Temprano T, Salas-Puig J, Calleja-Puerta S, Zanabili Al-Sibbai AA, Lahoz CC. (2009).Epilepsia postictus. Rev Neurol. 48: 171-177.
- Vespa PM, O'Phelan K, Shah M, Mirabelli J, Starkman S, Kidwell C et al. (2003). Acute seizures after intracerebral hemorrhage: a factor in progressive midline shift and outcome. Neurology. 60:1441-1446.
- 55120 lecturas