Ictus de base genética: CADASIL
La arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatía (CADASIL, Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy) es una enfermedad cerebrovascular hereditaria poco frecuente, debida a una mutación del gen Notch3 en el brazo corto del cromosoma 19.
HISTORIA
La primera descripción clínico-patológica se remonta a 1977, cuando Sourander y Walinder describieron una nueva entidad de herencia autosómica dominante a la que denominaron “demencia hereditaria multi-infarto”, caracterizada por la presencia de síntomas/signos piramidales, bulbares y cerebelosos, de aparición en la cuarta década y que progresaban a la demencia y a la muerte en 10-15 años (Sourander et al.; 1977). En el estudio necrópsico realizado en tres pacientes se objetivaron infartos por enfermedad oclusiva de las pequeñas arterias y arteriolas intracerebrales y leptomeníngeas.
Ese mismo año, Stevens et al. publicaron una entidad similar a la que denominaron “encefalopatía vascular crónica familiar” (Stevens et al.; 1977).
En 1991, Davous et al. consideraron que todas estas aportaciones correspondían a la misma enfermedad, a la que denominaron “leucoencefalopatía arteriopática familiar”, caracterizada anatomo-patológicamente por una leucoencefalopatía vascular, diferente de la enfermedad de Binswanger y de la angiopatía amiloide (Davous et al.; 1991).
En 1993, Tournier-Lasserve et al. realizaron un análisis de ligamiento genético en dos familias con infartos subcorticales y leucoencefalopatía, con una angiopatía no arterioscleróstica y no amiloidea como sustrato (Tournier-Lasserve et al.; 1993). Localizaron el gen responsable de la enfermedad en el cromosoma 19. Por primera vez propusieron el acrónimo CADASIL (OMIM 125310).
En 1996, Joutel et al. caracterizaron el gen Notch3 humano e identificaron alteraciones en la proteína Notch3 como origen del CADASIL(Joutel et al.; 1996).
Desde entonces se han descrito varias familias españolas con esta enfermedad (Avila et al.; 2007, Badia et al.; 2005, de la Pena et al.; 2001, Gutierrez-Molina et al., 1994, Posada et al.; 2003).
FISIOPATOLOGIA
No se conoce todavía el mecanismo último por el que se produce la degeneración de la célula muscular lisa a nivel vascular cerebral.
El gen Notch3 consta de 33 exones que codifican la proteína Notch3, que tiene 2321 aminoácidos. La mayoría de las mutaciones se producen en los exones 3 y 4. Se han descrito varios casos en la literatura de mutaciones de novo (Joutel et al.; 2000).
En las familias españolas publicadas se encontraron las siguientes mutaciones: 346C>T en el exón 3 (Avila et al.; 2007), 406C>T en el exón 3 (Posada et al.; 2003) y 659G>A en el exón 4 (Badia et al.; 2005).
El gen Notch3 codifica un receptor transmembrana que se expresa en el músculo liso de la pared arterial y que contiene 2 regiones: un dominio extracelular que tiene actividad reguladora y un dominio intracelular que tiene actividad transductora de señales propia. El componente extracelular contiene 34 repeticiones del EGF (Epidermic Growth Factor) y actúa como receptor de membrana. Su activación por un ligando específico induce la rotura de la proteína en sus dos componentes. El componente intracelular compuesto por 6 dominios de ankyrina se introduce entonces en el núcleo y podría actuar como un factor de transcripción, activación o inhibición de la expresión del gen Notch3 (Joutel et al.; 2000).
La mutación del gen Notch3 produce habitualmente la adición o pérdida de un residuo de cisteína en la parte extracelular de la proteína Notch3. Como consecuencia, el número de residuos de cisteína, que en condiciones normales es par, pasa a ser impar, lo que conlleva un cambio en la estructura secundaria de esta parte de la proteína. La función del receptor queda inhibida y la proteína defectuosa no puede ser metabolizada, acumulándose en la membrana citoplásmica de las células de músculo liso de la pared arterial (Joutel et al.; 2000).
De la Peña et al. plantearon en el 2001 la posibilidad de una alteración en la fosforilación oxidativa mitocondrial, al encontrar en pacientes de una familia española con CADASIL un defecto en la actividad del complejo I (NADH deshidrogenasa) en células musculares y del complejo V (ATP sintasa) en fibroblastos (de la Peña et al.; 2001).
CLINICA
Desde el punto de vista clínico se caracteriza por la presencia de migrañas con aura, de eventos cerebrovasculares recurrentes (ictus o accidentes isquémicos transitorios de diversa localización), de alteraciones psiquiátricas y de demencia de perfil subcortical. Estas manifestaciones pueden variar en las distintas familias descritas e incluso entre los diferentes miembros de una misma familia. La edad media de comienzo se sitúa en torno a los 40-45 años (Davous; 1998), pero si se considera la migraña como síntoma de comienzo desciende a 20-25 años. La supervivencia suele ser de 60-70 años (Dichgans et al.; 1998).
Las migrañas suelen ser la primera manifestación de la enfermedad y aparecen en la tercera década de la vida (Sempere et al.; 2004). Se producen en el 30% de los pacientes (Desmond et al.; 1999). Pueden ir precedidas de aura típica o atípica.
Los eventos cerebrovasculares son la manifestación más frecuente de CADASIL y afectan al 70% de los pacientes (Dichgans et al.; 1998). Son de localización subcortical y suelen presentarse como síndromes lacunares, aunque también pueden cursar como ataques isquémicos transitorios. Suelen aparecer entre la cuarta y quinta décadas.
El 10-20% de los pacientes desarrollan trastornos psiquiátricos, fundamentalmente alteraciones del ánimo (episodios de depresión, manía) o psicosis. Estos suelen relacionarse con el deterioro cognitivo (Chabriat et al.; 2007).
Finalmente, los pacientes desarrollan un cuadro de demencia subcortical entre la sexta y séptima década de la vida. Este deterioro cognitivo se ha relacionado con los infartos lacunares, al interrumpir los circuitos subcorticofrontales. El curso progresivo puede ser escalonado, subagudo o progresivo. Algunos pacientes pueden desarrollar demencia sin historia de ictus (Mellies et al.; 1998).
PRUEBAS COMPLEMENTARIAS
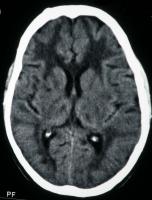
En la tomografía computerizada (TC) craneal pueden visualizarse áreas hipodensas periventriculares (Figura 1).
Figura 1. Tomografía craneal que muestra áreas hipodensas periventriculares.
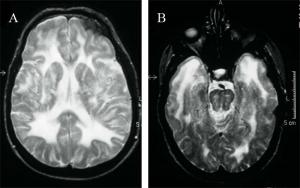
En la resonancia magnética (RM) se objetivan lesiones extensas y confluyentes de la sustancia blanca bilateral (fundamentalmente a nivel periventricular y en sustancia blanca profunda) (Figura 2A) que aparecen hipointensas en T1 e hiperintensas en T2, así como la presencia de infartos subcorticales, predominantemente en los ganglios basales y a nivel del tronco (Chabriat et al.; 1998). También se ha descrito una mayor afectación a nivel de los lóbulos temporales (Figura 2B), en la cápsula externa y en el cuerpo calloso (O'Sullivan et al.; 2001). Por el contrario, la afectación de áreas corticales o cerebelosas es excepcional.
Figura 2A. Resonancia magnética nuclear, corte axial ponderado en T2 que muestra lesiones extensas y confluyentes de la sustancia blanca bilateral. Figura 2B. Resonancia magnética nuclear, corte axial ponderado en T2 que muestra la afectación de los lóbulos temporales.
Estas alteraciones en la RM aparecen en todos los pacientes con la enfermedad, así como en portadores asintomáticos de la mutación (Scott et al.; 1999). A los 40 años, el 100% de los pacientes con CADASIL presentan lesiones radiológicas. La frecuencia y severidad de estas alteraciones aumentan de forma exponencial a partir de los 40 años, siendo muy severas en general a partir de los 55 años (Navarro et al.; 2002). En general las lesiones son más frecuentes y severas en los pacientes sintomáticos.
Dichgans et al. correlacionaron en 1999 el volumen lesional en la RM con el grado de incapacidad (evaluado mediante la escala de Rankin) y de manera inversa con la situación cognitiva (evaluada mediante el MMSE) (Dichgans et al.; 1999).
Con respecto al SPECT cerebral (single photon emission computed tomography), Scheid et al. realizaron un estudio neuropsicológico, RM y SPECT a tres pacientes con CADASIL (Scheid et al.; 2006). No hallaron correlación entre la situación cognitiva y los hallazgos radiológicos. Por el contrario Mellies et al. realizaron un SPECT a 13 pacientes de una familia alemana con CADASIL, y hallaron una correlación entre la presencia de deterioro cognitivo y un patrón de hipoperfusión a nivel frontal, temporal y en ganglios basales (Mellies et al.; 1998). Esta reducción en el flujo sanguíneo cerebral coincidía con la alteración de señal hallada en la RM.
El PET cerebral (positron emission tomography) con 18F-FDG realizado en 11 pacientes con CADASIL mostró una marcada reducción del metabolismo de glucosa a nivel cortical, asimétrico, en probable relación con una reducción del flujo sanguíneo cerebral y con una pérdida neuronal (Tatsch et al.; 2003).
La arteriografía cerebral suele ser normal. Por otro lado, se ha descrito una mayor frecuencia de complicaciones neurológicas al realizar una arteriografía en estos pacientes, por lo que no se recomienda su realización (Dichgans et al.; 1997).
DIAGNÓSTICO
El diagnóstico puede hacerse en base al estudio ultraestructural de la biopsia cutánea que muestra la presencia de un material granular osmiofílico en la lámina basal de los vasos, si bien la sensibilidad de la biopsia es de aproximadamente el 45% (Markus et al.; 2002). Esta sensibilidad aumenta en los pacientes con antecedentes familiares (Ampuero et al.; 2009). La utilización de una inmunotinción con anticuerpos monoclonales específicos frente a la proteína Notch3 en la biopsia cutánea también aumenta la sensibilidad de la biopsia (Joutel et al.; 2001).
Hoy en día el estudio genético del gen Notch3 es la prueba de elección para el diagnóstico en el CADASIL, dada la simplicidad de su realización y su sensibilidad.
En la Tabla 1 se resumen los criterios diagnósticos propuestos por Davous en 1998 (Davous; 1998).
Tabla 1. Criterios diagnósticos propuestos por Davous en 1998 (Davous; 1998).
DIAGNÓSTICO DIFERENCIAL
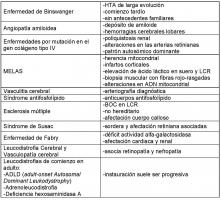
El diagnóstico diferencial se plantea con la enfermedad de Binswanger, si bien ésta aparece en pacientes de mayor edad, con factores de riesgo vascular y no sigue un patrón de herencia autosómico dominante (Posada et al.; 2003). También puede ser de ayuda en el diagnóstico el patrón de afectación radiológica (en el CADASIL existe una afectación predominante a nivel temporal en la cápsula externa y en el cuerpo calloso (O'Sullivan et al.; 2001).
Así mismo se puede plantear con la angiopatía amiloide, si bien ésta suele cursar con hemorragias lobares de repetición, mientras que en el CADASIL las paredes arteriales no son propensas a la rotura y las hemorragias cerebrales son infrecuentes (éstas se suelen producir en fases terminales de la enfermedad o en relación con el tratamiento anticoagulante). Además, en el estudio histológico se encuentran depósitos de amiloide en las paredes de los vasos.
Las enfermedades por mutación en el gen colágeno tipo IV que presentan un patrón autosómico dominante, son otra de las patologías causantes de leucoencefalopatía vascular isquémica y hemorrágica, se asocian a poliquistosis renal y alteraciones en las arterias retinianas (Plaisier et al 2007).
Algunas enfermedades mitocondriales, como el MELAS (Miopatía, Encefalopatía mitocondrial, Acidosis láctica y episodios Stroke-like) cursan con infartos cerebrales, tanto subcorticales como corticales, que frecuentemente no corresponden a territorios vasculares típicos. Tienen una herencia materna.
La Leucodistrofia Cerebral y Vasculopatía Retiniana (RVCL, Retinal Vasculopathy and cerebral Leukodystrophy), debida a mutaciones en TREX1, la principal exonucleasa 3’-5’ engloba tres diferentes entidades descritas previamente: la Vasculopatía Cerebrorretiniana (CRV, Cerebroretinal Vasculopathy); la Retinopatía Vascular Hereditaria (HVR, Hereditary Vascular Retinopathy) y la Endoteliopatía, Retinopatía y Neuropatía Hereditarias (HERNS, Hereditary Endotheliopathy, Retinopathy and Nephropathy) (Kavanagh et al.; 2008). Suele cursar con retinopatía y la instauración suele ser progresiva.
Las imágenes radiológicas pueden plantear el diagnóstico diferencial con algunas leucodistrofias de inicio en el adulto, si bien en estos casos la instauración suele ser progresiva.
En la Tabla 2 se resumen los principales diagnósticos diferenciales.
Tabla 2. Diagnóstico diferencial del CADASIL
ANATOMÍA PATOLOGICA
Se trata de una arteriopatía de pequeño y mediano vaso de carácter generalizado, a pesar de lo cual sólo se manifiesta clínicamente con síntomas neurológicos. Un extenso estudio anatomopatológico realizado en una familia alemana en 1996 demostró la existencia de alteraciones vasculares en corazón, riñón, hígado, intestino delgado y grueso, músculo, nervio y piel (Bergmann et al.; 1996).
Las mutaciones en el gen Notch3 producen un depósito extracelular de material granular osmiófilo (GOM), PAS positivo, basófilo, en la capa media de las arterias cerebrales de pequeño y mediano calibre, junto a la membrana basal de las células musculares (Navarro et al.; 2002). Además, las células del músculo liso de la pared arterial degeneran y desaparecen. Puede existir un adelgazamiento de la íntima.
Las lesiones cerebrales se producen por estenosis de la luz arterial. Consisten en una leucoenccefalopatía difusa, así como infartos subcorticales que afectan a la sustancia blanca, ganglios basales y protuberancia.
TRATAMIENTO
No existe ningún tratamiento específico de esta enfermedad.
Dado que cursa con eventos cerebrovasculares, se suelen prescribir antiagregantes, aunque sus efectos no han sido evaluados. Así mismo, está indicado el adecuado control de los factores de riesgo cerebrovascular. Por el contrario, está contraindicada la utilización de anticoagulación oral por el riesgo de hemorragia cerebral.
También pueden emplearse fármacos vasculotrópicos, como la pentoxifilina, que actúan sobre la microcirculación (Navarro et al.; 2002).
Dichgans et al. realizaron en 2008 un estudio randomizado doble ciego para valorar la potencial utilidad del tratamiento con donepezilo en 168 pacientes con CADASIL y deterioro cognitivo vascular subcortical, aunque no encontraron ningún claro beneficio clínico con dicho tratamiento (Dichgans et al.; 2008).
Posada et al. sugirieron que el tratamiento con galantamina en pacientes con demencia y CADASIL podría producir un beneficio clínico en algunos aspectos, aunque los 4 pacientes que estuvieron empleando galantamina durante 24 semanas empeoraron en el ADAS-cog (Posada et al.; 2008).
El consejo genético juega un papel importante en los pacientes diagnosticados de CADASIL que deseen tener descendencia.
CARASIL
Por otro lado, la arteriopatía cerebral autosómica recesiva con infartos subcorticales y leucoencefalopatía (CARASIL, Cerebral Autosomal Recessive Arteriopathy with Subcortical Infarcts and Leukoencephalopathy; OMIM 125310) es una enfermedad poco conocida, descrita fundamentalmente en la literatura japonesa (Lopez et al.; 2009). Se trata de una arteriopatía de pequeño vaso cerebral, no hipertensiva, que asocia infartos subcorticales, espondilosis y alopecia que se desarrolla en edades medias de la vida.
Desde el punto de vista anatomo-patológico, se ha descrito arteriosclerosis con engrosamiento de la íntima, fibras de colágeno densas, pérdida de células musculares lisas en los vasos y degeneración hialina de la túnica media en las pequeñas arterias cerebrales(Oide et al.; 2008).
En el 2009, Hara et al. realizaron un análisis de ligamiento en 5 familias con CARASIL y localizaron el gen responsable, HTRA1 en el cromosoma 10q. HTRA1 es una serina proteasa que inhibe la señalización de los miembros de la familia TGF-beta (transforming growth factor beta; factor de crecimiento transformante), que está implicada en la angiogénesis y el remodelamiento vascular (Hara et al.; 2009).
BIBLIOGRAFÍA
Ampuero, I., Alegre-Abarrategui, J., Rodal, I., España, A., Ros, R., Sendon, J. L., et al. (2009). On the diagnosis of CADASIL. Journal of Alzheimer's Disease. 17: 787-794.
Avila, A., Bello, J., Maho, P., Gomez, M. I. (2007). A new spanish family with CADASIL associated with 346C>T mutation of NOTCH3 gene. Neurologia. 22: 484-487.
Badia, M. C., Coret, F., Chamarro, R. (2005). CADASIL: Study of a family. Neurologia. 20: 382-383.
Bergmann, M., Ebke, M., Yuan, Y., Bruck, W., Mugler, M., Schwendemann, G. (1996). Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy (CADASIL): A morphological study of a german family. Acta Neuropathologica. 92: 341-350.
Chabriat, H., Bousser, M. G. (2007). Neuropsychiatric manifestations in CADASIL. Dialogues in Clinical Neuroscience. 9: 199-208.
Chabriat, H., Levy, C., Taillia, H., Iba-Zizen, M. T., Vahedi, K., Joutel, A., et al. (1998). Patterns of MRI lesions in CADASIL. Neurology. 51: 452-457.
Davous, P. (1998). CADASIL: A review with proposed diagnostic criteria. European Journal of Neurology. 5: 219-233.
Davous, P., Fallet-Bianco, C. (1991). Familial subcortical dementia with arteriopathic leukoencephalopathy. A clinico-pathological case. Revue Neurologique. 147: 376-384.
de la Peña, P., Bornstein, B., del Hoyo, P., Fernandez-Moreno, M. A., Martin, M. A., Campos, Y., et al. (2001). Mitochondrial dysfunction associated with a mutation in the Notch3 gene in a CADASIL family. Neurology. 57: 1235-1238.
Desmond, D. W., Moroney, J. T., Lynch, T., Chan, S., Chin, S. S., Mohr, J. P. (1999). The natural history of CADASIL: A pooled analysis of previously published cases. Stroke. 30: 1230-1233.
Dichgans, M., Filippi, M., Bruning, R., Iannucci, G., Berchtenbreiter, C., Minicucci, L., et al. (1999). Quantitative MRI in CADASIL: Correlation with disability and cognitive performance. Neurology. 52: 1361-1367.
Dichgans, M., Markus, H. S., Salloway, S., Verkkoniemi, A., Moline, M., Wang, Q., et al. (2008). Donepezil in patients with subcortical vascular cognitive impairment: A randomised double-blind trial in CADASIL. Lancet Neurology. 7: 310-318.
Dichgans, M., Mayer, M., Uttner, I., Bruning, R., Muller-Hocker, J., Rungger, G., et al. (1998). The phenotypic spectrum of CADASIL: Clinical findings in 102 cases. Annals of Neurology. 44: 731-739.
Dichgans, M., Petersen, D. (1997). Angiographic complications in CADASIL. Lancet. 349: 776-777.
Gutierrez-Molina, M., Caminero Rodriguez, A., Martinez Garcia, C., Arpa Gutierrez, J., Morales Bastos, C., Amer, G. (1994). Small arterial granular degeneration in familial binswanger's syndrome. Acta Neuropathologica. 87: 98-105.
Hara, K., Shiga, A., Fukutake, T., Nozaki, H., Miyashita, A., Yokoseki, A., et al. (2009). Association of HTRA1 mutations and familial ischemic cerebral small-vessel disease. The New England Journal of Medicine. 360: 1729-1739.
Joutel, A., Andreux, F., Gaulis, S., Domenga, V., Cecillon, M., Battail, N., et al. (2000). The ectodomain of the Notch3 receptor accumulates within the cerebrovasculature of CADASIL patients. The Journal of Clinical Investigation. 105: 597-605.
Joutel, A., Corpechot, C., Ducros, A., Vahedi, K., Chabriat, H., Mouton, P., et al. (1996). Notch3 mutations in CADASIL, a hereditary adult-onset condition causing stroke and dementia. Nature. 383: 707-710.
Joutel, A., Dodick, D. D., Parisi, J. E., Cecillon, M., Tournier-Lasserve, E., Bousser, M. G. (2000). De novo mutation in the Notch3 gene causing CADASIL. Annals of Neurology. 47: 388-391.
Joutel, A., Favrole, P., Labauge, P., Chabriat, H., Lescoat, C., Andreux, F., et al. (2001). Skin biopsy immunostaining with a Notch3 monoclonal antibody for CADASIL diagnosis. Lancet. 358: 2049-2051.
Kavanagh, D., Spitzer, D., Kothari, P. H., Shaikh, A., Liszewski, M. K., Richards, A., et al. (2008). New roles for the major human 3'-5' exonuclease TREX1 in human disease. Cell Cycle. 7: 1718-1725.
Lopez, J. I., Vilanova, J. R. (2009). CADASIL and CARASIL. Neurologia. 24: 125-130.
Markus, H. S., Martin, R. J., Simpson, M. A., Dong, Y. B., Ali, N., Crosby, A. H., et al. (2002). Diagnostic strategies in CADASIL. Neurology. 59: 1134-1138.
Mellies, J. K., Baumer, T., Muller, J. A., Tournier-Lasserve, E., Chabriat, H., Knobloch, O., et al. (1998). SPECT study of a german CADASIL family: A phenotype with migraine and progressive dementia only. Neurology. 50: 1715-1721.
Navarro, E., Diaz, F., Munoz, L., Gimenez-Roldan, S. (2002). Dominant autosomal cerebral arteriopathy with subcortical infarcts and leukoencephalopathy (CADASIL). A review. Neurologia. 17: 410-417.
Oide, T., Nakayama, H., Yanagawa, S., Ito, N., Ikeda, S., Arima, K. (2008). Extensive loss of arterial medial smooth muscle cells and mural extracellular matrix in cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy (CARASIL). Neuropathology. 28: 132-142.
O'Sullivan, M., Jarosz, J. M., Martin, R. J., Deasy, N., Powell, J. F., Markus, H. S. (2001). MRI hyperintensities of the temporal lobe and external capsule in patients with CADASIL. Neurology. 56: 628-634.
Emmanuelle Plaisier E, , Olivier Gribouval, Sonia Alamowitch, Béatrice Mougenot, Catherine Prost et al (2007). COL4A1 Mutations and Hereditary Angiopathy, Nephropathy, Aneurysms, and Muscle Cramps N Engl J Med 2007;357:2687-95.
Posada, I. J., Ferrero, M., Lopez-Valdes, E., Goni-Imizcoz, M. (2008). Galantamine therapy in dementia associated with CADASIL. Revista De Neurologia. 47: 299-300.
Posada, I. J., Garcia-Morales, I., Martinez, M. A., Hoenicka, J., Bermejo, F. (2003). CADASIL: A case with clinical, radiological, histological and genetic diagnoses. Neurologia. 18: 229-233.
Scheid, R., Preul, C., Lincke, T., Matthes, G., Schroeter, M. L., Guthke, T., et al. (2006). Correlation of cognitive status, MRI- and SPECT-imaging in CADASIL patients. European Journal of Neurology. 13: 363-370.
Scott, J. N., Metz, L., Hu, W. Y., Hudon, M. (1999). Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy (CADASIL). The Canadian Journal of Neurological Sciences. 26: 311-312.
Sempere, A. P., Perez-Tur, J., Garcia-Barragan, N., Selles, J., Medrano, V., Mola, S. (2004). Clinical and neuroimaging findings in a family with CADASIL associated to C475T mutation. Revista De Neurologia. 38: 37-41.
Sourander, P., Walinder, J. (1977). Hereditary multi-infarct dementia. morphological and clinical studies of a new disease. Acta Neuropathologica. 39: 247-254.
Stevens, D. L., Hewlett, R. H., Brownell, B. (1977). Chronic familial vascular encephalopathy. Lancet. 1: 1364-1365.
Tatsch, K., Koch, W., Linke, R., Poepperl, G., Peters, N., Holtmannspoetter, M., et al. (2003). Cortical hypometabolism and crossed cerebellar diaschisis suggest subcortically induced disconnection in CADASIL: An 18F-FDG PET study. Journal of Nuclear Medicine 44: 862-869.
Tournier-Lasserve, E., Joutel, A., Melki, J., Weissenbach, J., Lathrop, G. M., Chabriat, H., et al. (1993). Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy maps to chromosome 19q12. Nature Genetics. 3: 256-259.
- 44511 lecturas